【本站讯】近日,国际著名期刊《自然-通讯》(Nature Communications)刊载我校化学工程学院题为《短肽自组装纳米带证实β折叠片之间极性拉链结构的形成》(Nanoribbons self-assembled from short peptides demonstrate the formation of polar zippers between β-sheets)的研究论文(Nat. Commun. 2018, 9, 5118)。该论文是生物界面与材料研究团队在短肽自组装调控机制方面取得的重要研究进展,化学工程学院2013级博士研究生王蒙为论文第一作者,王继乾教授、吕建仁教授和徐海教授为通讯作者,红宝石9999hbs(华东)为论文第一署名单位。

生物界面与材料团队徐海教授、王继乾教授
新颖组装基元的设计、组装过程和结构的动态调控、生物学功能组装体系的构筑是超分子化学和自组装领域研究的核心问题。生物界面与材料团队设计了系列小分子短肽,通过原子力显微镜、小角中子散射、固体核磁等技术研究了其自组装过程和结构。生物界面与材料团队研究发现极性氨基酸拉链结构也可以在β折叠片之间形成,这是一种新型的超二级结构。相对于非极性的亮氨酸拉链,极性氨基酸拉链比较少见。
这一新的研究成果是在诺贝尔化学奖得主、著名生物化学家Max Perutz(马克斯·佩鲁茨)在上世纪90年代提出的通过极性氨基酸侧链的氢键作用,在聚谷氨酰胺链(strand)之间形成,可以稳定β折叠二级结构的概念基础上的一个重大进展。这一发现不仅有助于蛋白质和多肽的分级组装过程的认识和调控,还对肽基功能材料的设计和开发具有指导意义。
由于分子结构、物理化学性质和生物功能的多样性,多肽作为自组装基元近年来备受关注,该类分子除了可以模拟蛋白质在体内的折叠和组装外,还可通过简单的分子设计体外构筑新型的生物功能材料,比如生物3D打印材料,抗菌、药物控释材料,医用快速止血材料等。这也是该团队继去年发现短肽自组装手性传递规律后(J. Am. Chem. Soc. 2017, 139, 4185–4194.),在短肽自组装调控方面取得的另一重要进展。
同行审稿专家高度评价了该研究工作的细致性和严谨性,并且认为对探索多肽自组装中高级有序结构的构筑和调控具有重要意义。
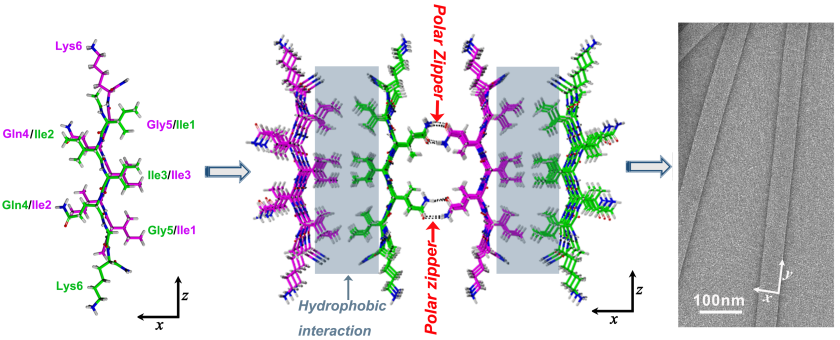
短肽自组装体中的“极性拉链”结构
在国家自然科学基金委的资助下,由徐海教授和王继乾教授共同负责的生物界面与材料研究团队,近年来一直致力于短肽分子自组装及功能化的研究。今年,他们通过合理的分子设计,构建了尺寸不同的肽纳米管,实现了组装体尺寸的定向调控。相关研究成果《通过Bola型两亲短肽序列设计控制自组装纳米管直径》(Controlling the Diameters of Nanotubes Self-Assembled from Designed Peptide Bolaphiles)刊发在TOP期刊Small杂志上(Small, 2018, 14, 1703216)。论文通讯作者为徐海教授和吕建仁教授,第一作者为赵玉荣副教授,第一署名单位为红宝石9999hbs(华东)。另外,该团队还设计开发了系列具有高效抗菌、抗肿瘤和快速凝血性能的功能短肽,并申请了多项国家发明专利。
作为材料领域顶级期刊之一《自然-通讯》(Nature Communications)对论文质量要求非常严格。上述研究工作涉及大量的实验工作和谨慎的重复性求证工作,生物界面与材料团队历经多年艰苦卓绝的研究工作,期间克服了诸如团队核心研究成员离校就业等困难,突破了诸多研究难题,取得了今日的成果。
文章链接:https://www.nature.com/articles/s41467-018-07583-2

